海河文库 | 评估中国制造的塑料注射器的潜在设备故障:美国食品药品监督管理局安全沟通

美国食品药品监督管理局(FDA)正在通知消费者、医疗保健提供者和医疗保健机构,FDA正在评估中国制造的塑料注射器可能出现的设备故障(如泄漏、破损和其他问题)。美国食品药品监督管理局正在收集和分析数据,以评估中国制造的用于向体内注射液体或从体内提取液体的塑料注射器。目前,该问题不包括玻璃注射器、预填充注射器或用于口腔或局部目的的注射器。
美国食品药品监督管理局收到了与几家中国注射器制造商有关的质量问题的信息。我们担心,某些在中国制造的注射器可能无法提供一致且充分的质量或性能。
对消费者、医疗保健提供者和设施的建议
此时,当美国食品药品监督管理局继续评估中国制造的塑料注射器时:
●通过查看标签、外包装或联系您的供应商或团购组织,检查您使用或库存中注射器的生产地点。
●如果可能的话,可以考虑使用非中国制造的注射器。此时,不包括玻璃注射器、预填充注射器或用于口腔或局部目的的注射器。
●如果您只有在中国生产的注射器,请根据需要继续使用,直到您能够使用替代注射器并密切监测泄漏、破损和其他问题。
设备说明
通常,注射器用于将液体注射到身体中或从身体中提取液体,并可用于各种临床和家庭健康环境中。一些注射器也可以与输注泵一起使用,以受控的方式将流体输送到体内。
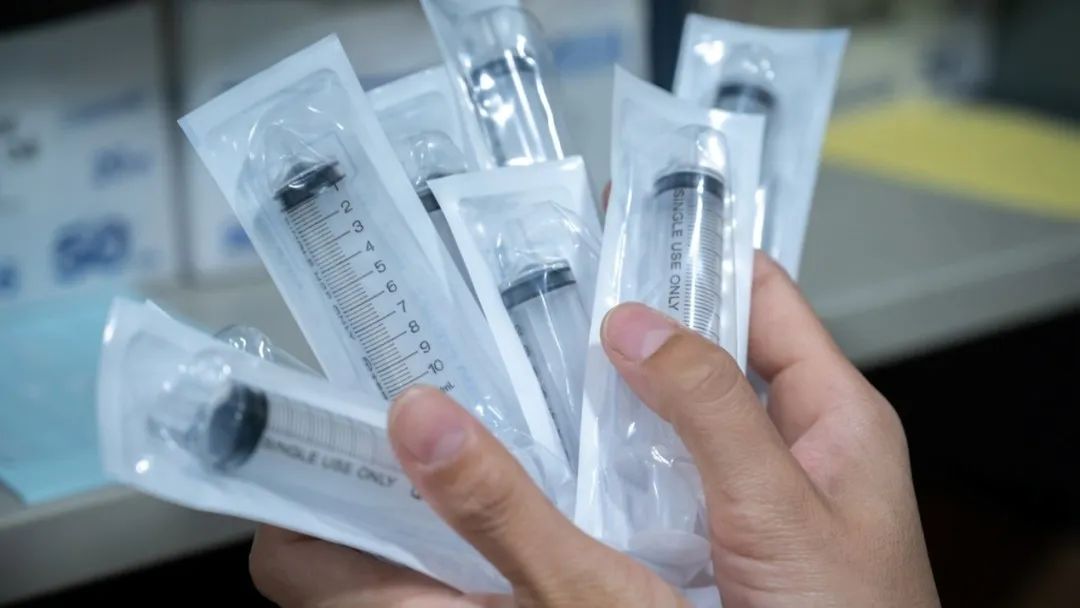
检查您使用或库存中注射器的生产地点。
潜在注射器故障
到目前为止,美国食品药品监督管理局了解到最近注射器召回、医疗器械报告(MDR)以及关于中国各生产基地生产的注射器的其他投诉中存在的质量问题。报告的质量问题包括制造商更改注射器尺寸后的泄漏、破损和其他问题。这些质量问题可能会影响注射器的性能和安全性,包括它们在单独使用或与其他医疗设备(如输液泵)一起使用时输送正确剂量药物的能力。
美国食品药品监督管理局正在与联邦合作伙伴合作,进一步测试在中国生产的注射器。美国食品药品监督管理局计划与制造商合作,确保采取足够的纠正措施,并在必要时阻止中国制造的注射器进入美国。
此外,美国食品药品监督管理局将继续监测有关中国生产的注射器问题的报告。
我们将随时向公众提供更多信息。
如果你认为你的注射器或任何医疗设备有问题,美国食品药品监督管理局鼓励你通过MedWatch自愿报告表报告问题。
受美国食品药品监督管理局用户机构报告要求约束的机构雇用的卫生保健人员应遵守其机构制定的报告程序。
如果您遇到注射器或其他设备的供应问题,您可以就医疗设备供应链问题联系美国食品药品监督管理局。向美国食品药品监督管理局报告供应链问题有助于为防止短缺和保护患者健康的行动提供信息。
海河生物是一家专业为医疗器械和药品相关的研究机构、研发和生产企业以及相关监管部门提供产品全生命周期服务的平台性公司,在生物医药CRO领域具有极高的行业地位。海河生物旗下业务涵盖产品全生命周期服务、服务型制造、智能制造和第三方检测认证,与我国“十四五规划”高度契合。
致力于向医疗器械、药品、化妆品和消毒产品领域提供专业独立的第三方检测服务,已取得国家级CMA检验检测资质认定,中国CNAS、美国ANAB实验室能力认可,美国 FDA GLP和OECD GLP实验室认可以及国际实验动物评估和认可委员会AAALAC认证,真正做到了一次测试全球通用。
深耕于生物医药行业,熟悉中外各国的法规要求,尤其擅长中国NMPA注册和备案、美国FDA申请、欧盟CE认证、巴西ANVISA和加拿大卫生部的产品注册,可根据客户的市场开发方案和产品特点,量身定制全球市场准入战略规划,提早实现产品上市销售。
建设有无源耗材、有源设备和体外诊断试剂三条生产线,提供科研成果到最终成品委托开发和加工生产的完整解决方案。
为药品、医疗器械(尤其是体外诊断试剂)产品提供符合中国、美国和欧盟市场准入的临床方法验证确认及检测服务。

