文章详情
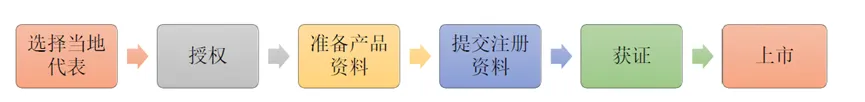
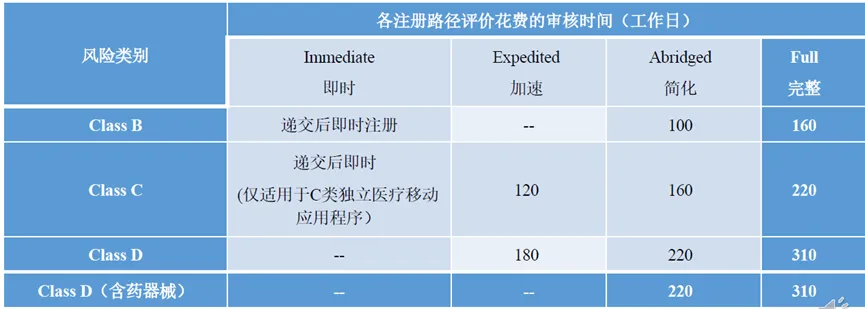
2025全球准入| 新加坡医疗器械注册要点
2025-02-10
来源:



海河生物视界
海河生物致力于为全球的医疗器械和药品研发、生产企业和科研机构提供产品全生命周期的一站式服务。
370篇原创内容
公众号
海河生物是一家专业为医疗器械和药品相关的研究机构、研发和生产企业以及相关监管部门提供产品全生命周期服务的平台性公司,在生物医药CRO领域具有极高的行业地位。海河生物旗下业务涵盖产品全生命周期服务、服务型制造、智能制造和第三方检测认证,与我国“十四五规划”高度契合。
从事医疗器械、药品、化妆品和生物医药环境标准化和定制检测和监测服务,具有国家级CMA、CNAS、美国ANAB、美国 FDA GLP和OECD GLP,报告认可度广泛。
向客户提供中国、美国、欧盟、巴西和加拿大等国家地区的医疗器械、药品和化妆品全生命周期法规政策咨询、注册认证辅导、上市后不良事件处理、技术转化、培训等相关服务。
建设有无源耗材、有源设备和体外诊断试剂三条生产线,提供科研成果到最终成品委托开发和加工生产的完整解决方案。
为药品、医疗器械(尤其是体外诊断试剂)产品提供符合中国、美国和欧盟市场准入的临床方法验证确认及检测服务。

分享
下一篇:这是最后一篇
上一篇:这是第一篇