海河文库|FDA发布Q-submission 电子模板草案,eSTAR 强制递交:医疗器械行业的新挑战与新机遇?

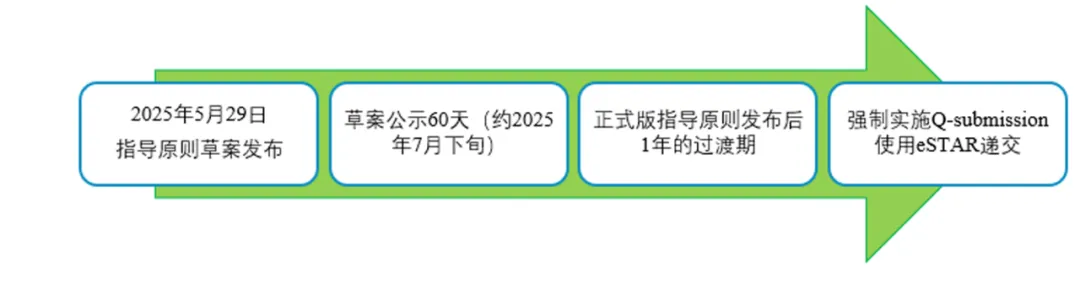
美国当地时间5月29日,FDA发布使用电子提交模板(eSTAR)提交医疗器械Q-Submission指导原则草案,在此指导原则草案中,FDA明确了计划要求Pre-Sub预提交(Q-Submission的常用类型)以电子方式提交,在最终指南发布日后会提供至少1年的过渡期。

1.时间线梳理

2.递交强制实施范围

目前,FDA仅要求预提交程序Pre-sub(Q-sub)类型的提交使用eSTAR递交,而提交资料问题反馈请求SIR,研究风险确定,信息会议,PMA100日会议等递交类型暂不强制使用eSTAR。在此草案最终定稿后,所有Pre-Subs,包括首次递交、补充和修正信息都将自实施日期后以电子方式递交。
递交格式:必须使用eSTAR结构化PDF模板,在FDA网站目前已有Version 1 PreSTAR可供下载
行政审核:FDA会在15天内完成器械描述准确性和附件完整性的验证
递交路径:CDRH产品通过CDRH Portal递交, CBER产品通过FDA Electronic Submission Gateway递交
豁免情况:交互审核回复可不通过PreSTAR递交,或者与FDA开会后汇总的会议纪要文件
3.PreSTAR模板结构


4.FDA审查流程

FDA在收到文件后15天内进行行政审核,若有需要补充资料,邮件通知制造商,制造商在180天内提供补充资料,补正后重启审查时钟(即重新15天计时),通过行政审核后进入实质审核。若未在规定时间内提供补正资料,则FDA视为申请撤回。
海河生物可以提供的服务
FDA 最新发布 Q-submission 电子模板草案,为器械企业提供标准化执行模板,对全球医疗器械企业的合规性提出了更明确的要求,海河生物深耕生物医药行业近20年,始终密切关注 FDA 最新监管要求,旗下咨询团队可提供医疗器械、药包材和药品的法规咨询、全球注册认证、质量管理体系建立和审核、产品临床评价不良事件处理等服务,目前已完成超 3000 个美国 FDA 510(k)申请,特别是为中国医疗器械所有细分领域的“首台套”进入欧美市场提供了咨询服务。在中国医疗器械产品逐浪出海的宏伟航程中,海河生物了解中国企业在注册申报中的痛点和难点,若您的器械出海美国市场需求,速邮件sales@mid-link.net 联系我们。
如需转载,请标明来自海河生物
